α-螺旋是蛋白二级结构最常见的一种,将其用于药物研发受到了大量关注。多肽的不稳定构象导致易被酶水解以及生物利用率低,这些都可以通过α-螺旋结构构象的稳定化来解决。Hydrocarbon stapled peptides是在特定位点引入化学交联的一种全烃化装订,将迷你蛋白锁定在他们的生物活性的α-螺旋构象中。多肽装订的理念是用于克服两大类治疗试剂的靶向细胞内蛋白相互作用的局限性:小分子和蛋白生物制剂。作为一类新兴的下一代药物,Stapled Peptide应该具备易于合成和容易进入细胞的能力,以及能够多靶标识别的生物活性。
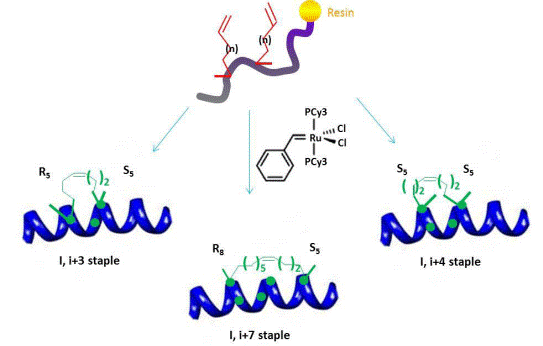
有两种构象化策略用于引入和稳定α-螺旋结构,即α双取代(甲基化螺旋骨架)和巨环桥形成(约束构象)。在多肽内装订从而使两个合适的空隔合并:α-甲基化,α-alkenylglycine残基,有确定的立体化学构象和烯烃链长度,然后在树脂上进行钌介导的烯烃复分解反应,从树脂上切割并去保护后便可产生Stapled Peptide。下图显示了在多肽中产生稳定α-螺旋的三种不同的全烃装订类型。α-甲基化和α-alkenylglycine用于每一种Stapled Peptide的生成,通常命名为XY,X表示在烯基侧链中a-carbon的空间化学位置(Cahn-Ingold-Prelog命名),Y表示长度。在固相多肽合成的过程中,α-甲基化,α-alkenylglycine交联氨基酸并入了合适的的位置。i, iStapled Peptide在i和i+3位置反别需要一单位的R5和S5. i,i+4 Stapled Peptide需要两单位的S5并入在对应的i和i+4位置。i,i+7 Stapled Peptide在i位置需要一单位R8,i+7位置需要一单位S5。用Grubbs I催化树脂连接多肽发生烯烃复分解反应,在2个非天然氨基酸之间发生交联,从而产生固定α-螺旋构象的Stapled Peptide。
Click Chemistry合成Stapled Peptide
“Click”反应(铜催化1,3-偶极环加成反应)高效且反应条件温和,加之必需非天然氨基酸容易
合成使得single triazole-stapled peptides容易合成。例如,L-Nle(εN3) 和 D-Pra (D- Propargylalanine)在i和i+4位置交联可用于产生single triazole-stapled peptides。

Stapled Peptide修饰
典型的Stapled Peptide修饰有两类:荧光标记和亲和标签。两种最常用的添加到Stapled Peptide N末端的基团是荧光素和生物素,荧光素用于研究细胞吸收和生物物理性质检测,生物素用于生理性质和体外靶向作用评估。这些修饰通常需要一个弹性的分子间隔以分隔Stapled Peptide核心和修饰基团。
N-乙酰化
交联点(β-丙氨酸,迷你-PEG 等)
荧光标记(FITC,5-FAM等)
装订在药物设计中的重要性:
引入烃装订可以产生高水平的α-螺旋,能增加5-5000倍的靶亲和力,保护其不被酶降解,提高细胞渗透能力通过细胞内吞囊泡进入,延长体内半衰期,在培养细胞内特异性阻止蛋白蛋白相互作用。
更好的靶亲和力
难被讲解,增加血清半衰期
通过内吞囊泡运输进入细胞
阻止蛋白蛋白相互作用
无免疫原性
可行的药物动力和体内稳定性
有研究证明Stapled Peptide可靶向多种癌症、糖尿病、HIV、动脉粥样硬化等疾病相关蛋白,这些蛋白包括像:BCL-2, BCL-XL, BAX, MCL-1, 葡萄糖激酶, hDM2, hDMX, NOTCH/CSL, HIV-1 衣壳, HIV-1 gp41, ABCA1 和雌激素受体。
设计和合成Stapled Peptide推荐文献:
Design and Structure of Stapled Peptides Binding to Estrogen Receptors
J. Am. Chem. Soc., 2011, 133 (25), pp 9696–9699
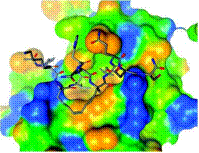
这篇文章描述了设计一系列结合到雌激素受体的共激活肽结合位点的新Stapled Peptide。这个设计使用了许多生物物理技术,包括受体-Stapled Peptide化合物晶体结构分析,这篇文章详细地描述了分子间反应,揭示了all-hydrocarbon staples调节分子识别。这些研究发现揭示了一般怎样设计Stapled Peptide